CAR-T细胞疗法研究进展(第39期)
来源:生物谷原创 2023-10-31 19:05
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science:重大进展!利用经过基因改造的益生菌引导CAR-T细胞有望成为一种安全有效治疗实体瘤的通用平台
doi:10.1126/science.add7034
几年来,科学家们已经成功地利用嵌合抗原受体(CAR)T细胞(CAR-T)靶向血细胞表面上的特定抗原来治疗白血病和淋巴瘤患者。但事实证明,利用CAR-T细胞靶向实体瘤(如乳腺癌和结肠癌)是特别困难的。实体瘤含有一系列显示出不同抗原的细胞,而且体内的健康细胞也往往携带这些抗原。因此,确定一种一致且安全的肿瘤靶标阻碍了大多数治疗实体瘤的 CAR-T 细胞疗法在开发的第一阶段取得成功。
在一项新的研究中,来自美国哥伦比亚大学的研究人员报告了一种攻击肿瘤的新方法。他们设计了肿瘤定植细菌(益生菌),让定植在肿瘤中的它们产生合成靶标,从而引导 CAR-T 细胞消灭这些含有合成靶标的癌细胞。相关研究结果发表在2023年10月13日的Science期刊上,论文标题为“Probiotic-guided CAR-T cells for solid tumor targeting”。
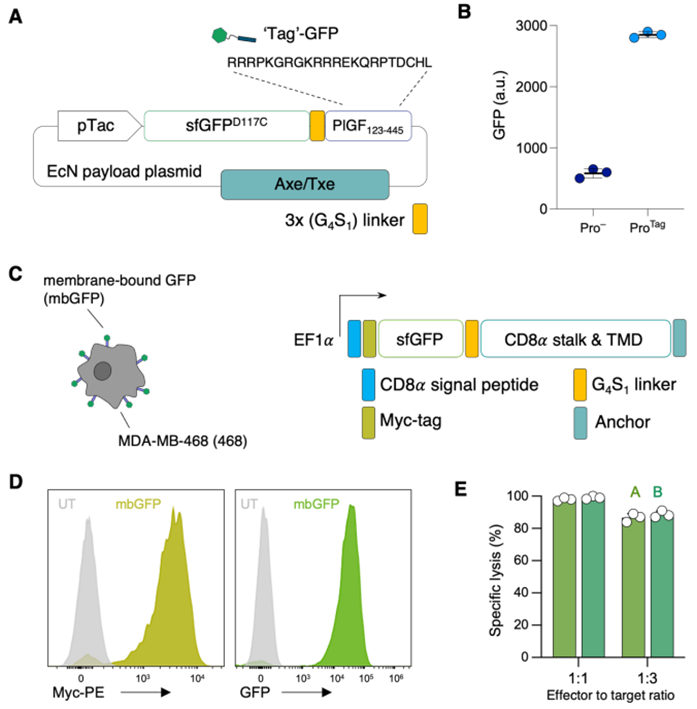
图片来自Science, 2023, doi:10.1126/science.add7034。
论文通讯作者、哥伦比亚大学生物医学工程学副教授Tal Danino说,“我们的益生菌平台能让CAR-T细胞攻击多种类型的肿瘤。传统的 CAR-T细胞疗法依赖于靶向天然肿瘤抗原。这是第一个将经过基因改造的T 细胞与经过基因改造的细菌配对,安全、系统、有效地向实体瘤递送合成抗原的例子。这将对许多癌症的治疗产生重大影响。”
Danino实验室通过对寻找肿瘤的细菌进行编程,在实体瘤上涂上CAR-T细胞能够识别的合成抗原,从根本上构建出能够攻击通用抗原的通用CAR-T细胞。这种益生菌引导的CAR-T细胞(probiotic-guided CAR-T cell, ProCAR)平台是这些作者首次成功地将经过基因改造的益生菌与CAR-T细胞结合在一起,而且还首次证明了CAR-T细胞对直接在肿瘤内产生的合成抗原有反应。
论文共同第一作者、Danino实验室博士生Rosa Vincent说,“将靶向肿瘤的细菌和CAR-T细胞结合在一起的优势,提供了一种新的肿瘤识别策略,这为开发经过基因改造后用于活体疗法的细菌群落奠定了基础。我们选择将这两种细胞疗法的最佳特点---利用细菌产生肿瘤靶标,利用T细胞消灭恶性肿瘤细胞---结合起来,从而弥补这两种疗法各自的局限性。”
2.Blood Adv:CAR-T细胞疗法对不同种族的多发性骨髓瘤患者都有效
doi:10.1182/bloodadvances.2023010894
根据一项新的研究,多发性骨髓瘤患者接受一种称为idecabtagene vicleucel(又称 ide-cel)的嵌合抗原受体(CAR)T细胞(CAR-T)疗法治疗后,无论种族和族裔,总生存期都没有差异。相关研究结果于2023年10月16日在线发表在Blood Advances期刊上,论文标题为“Racial and ethnic differences in clinical outcomes among multiple myeloma patients treated with CAR T-cell therapy”。

图片来自Blood Advances, 2023, doi:10.1182/bloodadvances.2023010894。
为了开展这项新的研究,Peres博士和她的研究团队收集了参加美国多发性骨髓瘤免疫疗法联盟(U.S. Multiple Myeloma Immunotherapy Consortium)的11家机构的207名患者的数据。共有149名患者(占72%)被认定为非西班牙裔白人,30名患者(占17%)被认定为非西班牙裔黑人,22名患者(占11%)被认定为西班牙裔。复发/难治性多发性骨髓瘤患者接受了ide-cel治疗,Peres团队监测了他们的缓解率、总生存率以及CAR-T细胞相关并发症的发生率,并在治疗后9个月左右对患者进行了随访。
这些研究结果表明非西班牙裔黑人患者(97%)比西班牙裔白人患者(77%)和非西班牙裔白人患者(85%)更有可能出现细胞因子释放综合征---一种导致炎症的潜在危险副作用。不过,Peres团队在比较不同种族和族裔患者的治疗结果时,并没有发现他们发生严重并发症的可能性有任何显著差异。同样地,他们发现黑人和白人患者在入住重症监护室的发生率、达到完全缓解的可能性以及总生存率方面也没有明显差异。
虽然与非西班牙裔黑人和白人患者相比,西班牙裔患者的总体反应率(即对 CAR-T 达到部分、非常好的部分或完全反应的患者比例)较低,但研究人员怀疑这可能部分归因于参与研究的西班牙裔患者人数有限。
3. Polym Advan Technol:一种新型聚合物化合物可将质粒DNA高效导入漂浮的T细胞中,为构建新一代CAR-T细胞铺平道路
doi:10.1002/pat.6136
在一项新的研究中,来自日本东京都立大学的研究人员发现了一种新型聚合物,它能在嵌合抗原受体(CAR)T 细胞(CAR-T)疗法(一种治疗血癌的关键细胞疗法)中有效地将质粒 DNA 运送到 T 细胞中。重要的是,它能将基因送入漂浮的T细胞中,而不仅仅是固定在表面的T细胞。它稳定、无毒,而且不使用病毒。它优于被视为该领域黄金标准的聚离子化合物,从而为新疗法铺平了道路。相关研究结果近期发表在Polymers for Advanced Technologies期刊上,论文标题为“Synthesis of guanidinium-dendrimer-type pDNA carriers for gene delivery into floating blood cells”。
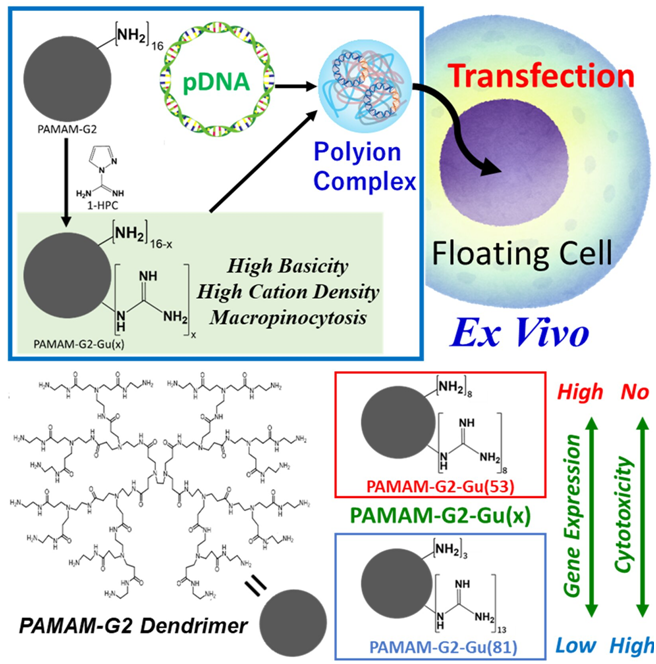
图片来自Polymers for Advanced Technologies, 2023, doi:10.1002/pat.6136。
在这项新的研究中,东京都立大学Shoichiro Asayama教授领导的一个研究小组构建出了一种新型聚合物化合物,它能有效地将质粒 DNA送入漂浮的 T 细胞。他们使用了树枝状聚合物(dendrimer),这种大型聚合物具有类似毛球的分支结构。具体来说,他们使用了第二代聚酰胺胺(PAMAM-G2);这里的第二代指的是从中心结构向外形成新枝的次数。在对这些分支末端进行修改的实验中,他们发现可以实现质粒 DNA与 PAMAM-G2 的一系列结合行为。
这些作者特别发现,将 PAMAM-G2 分支末端特定比例的伯胺基团替换为高碱性胍(Gu)基团后,PAMAM-G2 成为质粒 DNA的绝佳载体。PAMAM-G2-Gu 带有很高的电荷,而且大小适合于巨胞饮作用(macropinocytosis),这是细胞“吞食”和吸收外界物质的一种常见机制。
有了正确的配方,这种新型聚合物化合物在血浆中也是无毒和稳定的。最重要的是,在对浮游 T 细胞的测试中,PAMAM-G2-Gu(53)(53% 被胍取代)的性能明显优于支链聚乙烯亚胺(bPEI),后者是基因转染的黄金标准 PIC。
考虑到它们的低毒性和出色的载体特性,这些作者相信他们找到了用于下一代 CAR-T 细胞疗法中体内外转染的可行候选物,而CAR-T 细胞疗法正是多种危及生命的疾病患者的重要治疗选择。
4.南方医科大学的研究者们为增强肿瘤免疫治疗提供了一种更有效、更安全的CAR T细胞转化方法
doi:10.7150/ijbs.86632
近日,来自南方医科大学的研究者们在Int J Biol Sci.杂志上发表了题为“Enhanced tumor immunotherapy by polyfunctional CD19-CAR T cells engineered to secrete anti-CD47 single-chain variable fragment”的文章,本研究表明CAR T细胞局部递送抗CD47可能限制与全身抗体治疗相关的毒性,该研究为增强肿瘤免疫治疗提供了一种更有效、更安全的CAR T细胞转化方法。

CD19-s47-CAR - T细胞在人源化小鼠模型中的抗肿瘤和免疫调节作用。图片来源:https://pubmed.ncbi.nlm.nih.gov/37781526/
嵌合抗原受体T(CAR T)细胞治疗后非霍奇金淋巴瘤(NHL)的高复发率仍然是一个瓶颈,免疫抑制肿瘤微环境(TME)损害了CAR T细胞在NHL中的疗效是复发的主要原因。因此,改变CAR T细胞的结构以减弱TME的抑制作用从而降低复发率是一个有价值的研究课题。CD47已被证明是一个有前景的治疗靶点,在调节巨噬细胞功能方面至关重要。
在此,研究者改造CD19-CAR T细胞分泌抗CD47单链可变片段(scFv),并通过体外和体内研究验证了其在增强抗肿瘤疗效、调节T细胞分化、改变巨噬细胞吞噬和极化方面的功能。疗效与CAR T细胞和CD47抗体的组合类似或优选。值得注意的是,与亲代CAR T细胞相比,分泌抗CD47 scFv的CAR T电池在特异性抗原刺激后发挥更强大的免疫反应,其特征是更有效的脱颗粒和具有多功能性的细胞因子产生。此外,CAR T细胞局部递送抗CD47可能限制与全身抗体治疗相关的毒性。
5.Neuro-Oncology:靶向肿瘤相关抗原NLGN4X的TCR-T细胞有望治疗恶性脑肿瘤
doi:10.1093/neuonc/noad172
胶质母细胞瘤是最具侵袭性的脑肿瘤。它们在大脑中弥漫扩散,很难通过手术完全切除。化疗或放疗的效果也往往有限。为了给患者找到新的、更有效的治疗方案,医生和科学家们正在测试多种免疫治疗方法,包括所谓的“过继性”T细胞疗法:这包括从患者体内分离出 T 细胞,在培养皿中对它们进行改造,然后将它们移植回患者体内。医生们正在寻求各种方法。
在一项新的研究中,来自德国癌症研究中心和曼海姆大学医学中心的研究人员首次成功地在小鼠体内测试了一种新的脑肿瘤细胞免疫疗法。相关研究结果近期发表在Neuro-Oncology期刊上,论文标题为“NLGN4X TCR transgenic T cells to treat gliomas”。
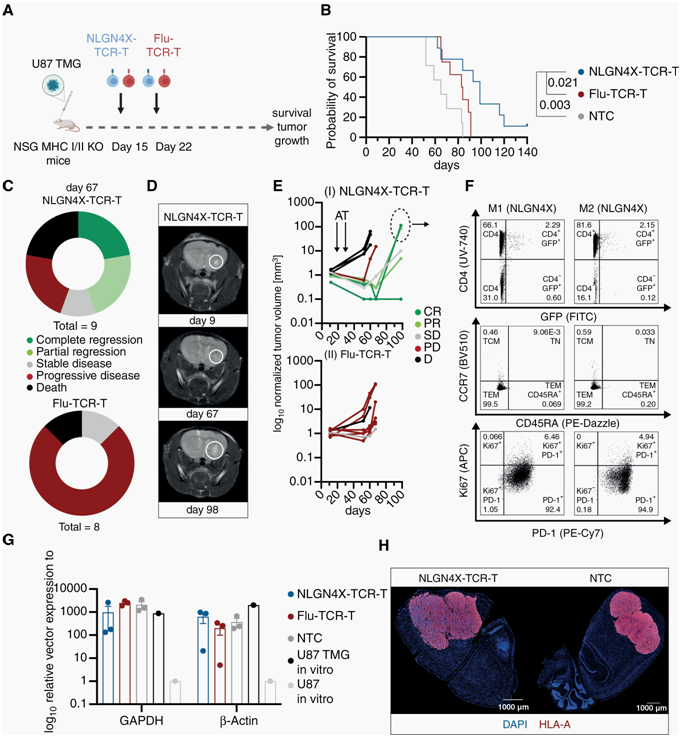
在颅内肿瘤模型中,脑室内给送NLGN4X-TCR-T导致肿瘤暂时消退并提高生存率。图片来自Neuro-Oncology, 2023, doi:10.1093/neuonc/noad172。
这些作者采用了“T细胞受体转基因T细胞(T cell receptor transgenic T cell, TCR-T细胞)”这一相对较新的概念。为此,他们首先给脑肿瘤患者接种了蛋白 NLGN4X(Neuroligin4X)的抗原片段。这种蛋白参与突触的形成。它大量存在于胶质母细胞瘤细胞中,但在健康脑组织中几乎检测不到。
论文通讯作者、德国癌症研究中心科学家Lukas Bunse及其研究团队随后从接种NLGN4X蛋白片段的参与者的血液中分离出被 NLGN4X 激活的 T 细胞,这些 T 细胞因此携带了一种能够特异性识别这种胶质母细胞瘤相关抗原的T细胞受体(TCR)。
不过,由于这种方法只能获得少量的 NLGN4X 特异性 T 细胞,不足以用于细胞疗法,因此这些作者使出了一招:他们分离出了 NLGN4X 特异性 T 细胞受体(TCR)的编码基因。然后,他们就能够在培养皿中将这个基因导入来自捐献者血液的 T 细胞。通过这种方法,他们成功地制造出大量具有相同特异性的 T 细胞,所有这些T细胞都能识别癌症抗原 NLGN4X。
Bunse团队接着证实这些NLGN4X 特异性 T 细胞能够杀死培养皿中的脑肿瘤细胞。利用这些经过基因改造后表达靶向NLGN4X的TCR的人类 T 细胞治疗脑肿瘤小鼠,治疗反应超过 40%。与未接受治疗的对照小鼠相比,它们的肿瘤缩小,存活时间更长。
6.Nat Cancer:靶向FLT3中D835Y驱动突变的TCR-T细胞有望治疗急性髓细胞性白血病
doi:10.1038/s43018-023-00642-8
在一项新的研究中,来自挪威奥斯陆大学、奥斯陆大学医院和瑞典卡罗林斯卡医学院的研究人员确定了一种治疗急性髓细胞性白血病(acute myeloid leukemia, AML)的潜在靶标:AML患者共有的一种突变:FLT3酪氨酸激酶结构域中经常出现的D835Y驱动突变。他们描述了一种T细胞受体(T-cell receptor, TCR),该TCR能够识别这种突变。这些研究结果为利用配备了这种治疗性T细胞受体的T细胞杀死白血病细胞提供了新的希望。相关研究结果于2023年10月2月在线发表在Nature Cancer期刊上,论文标题为“A T cell receptor targeting a recurrent driver mutation in FLT3 mediates elimination of primary human acute myeloid leukemia in vivo”。
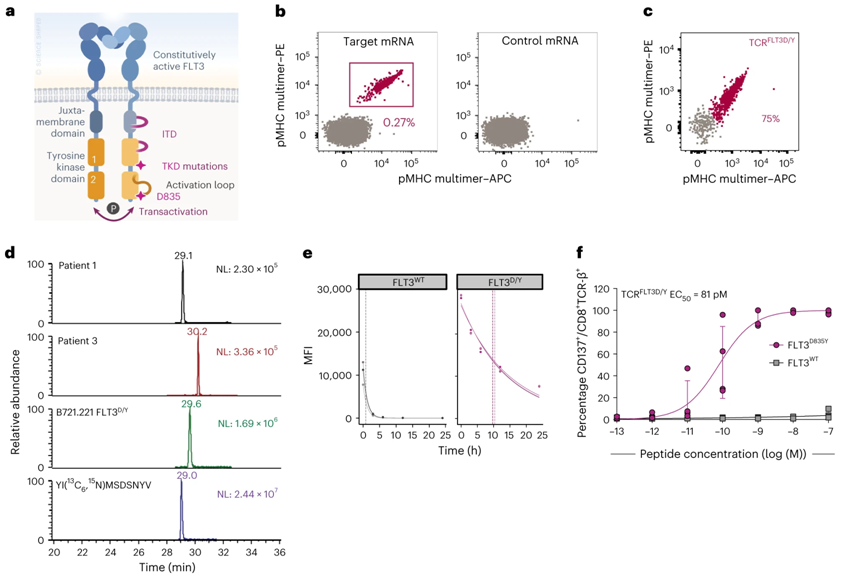
图片来自Nature Cancer, 2023, doi:10.1038/s43018-023-00642-8。
这些作者提供了重要的概念证明,即表达靶向AML患者都具有的突变的T细胞受体(TCR)的T细胞(TCR-T)可以成为治疗AML的一种有吸引力的选择。论文共同通讯作者、奥斯陆大学的Johanna Olweus教授说,“这为我们开发出治疗AML的有效新疗法带来了希望,这种方法可能也适用于其他类型的癌症。”
这些作者随后证实这种TCR-T细胞疗法是安全的。接着,他们又证实在多种疾病相关模型中,这种TCR-T细胞疗法能有效消除白血病细胞。利用TCR-T细胞或CAR-T细胞治疗AML的此类数据在该领域是非常少的。
7.JCI Insight:引入TSC2基因突变可构建出超级T细胞,有望用于治疗感染和癌症
doi:10.1172/jci.insight.167829
在一项新的研究中,来自美国约翰霍普金斯大学医学院的研究人员利用实验室培育的人类细胞和基因工程小鼠,证实对称为CD8+ T细胞的免疫细胞中的一种特定蛋白进行修饰能够让这些T细胞更加强健,从而有可能为更好地利用人体自身的免疫系统中的T细胞抗击癌症打开大门。相关研究结果于2023年10月3日在线发表在JCI Insight期刊上,论文标题为“TSC2 S1365A mutation potently regulates CD8+T cell function and differentiation improving adoptive cellular cancer therapy”。
论文通讯作者、约翰霍普金斯大学医学院心脏病学教授David Kass博士说,“最大限度地提高基于T细胞的疗法的有效性仍然是一个严峻的挑战。我们发现了一种增强 T 细胞功能的强大方法,为改善癌症免疫疗法和潜在治疗各种传染病和其他疾病提供了一条有前景的途径。”
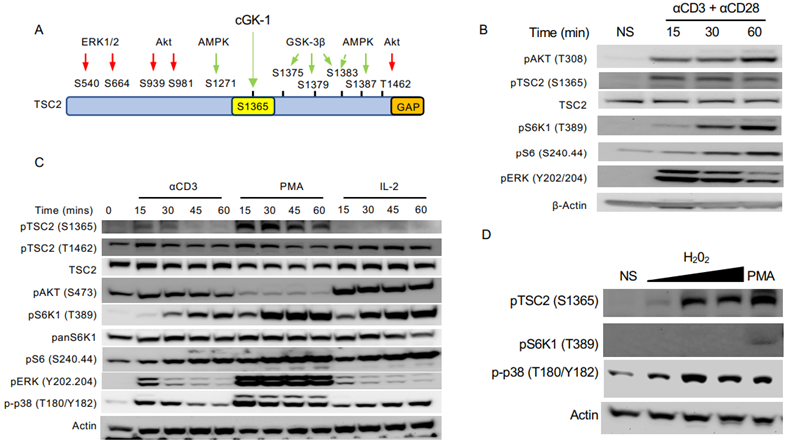
图片来自JCI Insight, 2023, doi:10.1172/jci.insight.167829。
在这项新的研究中,Kass团队重点研究了 CD8+ T 细胞,这些循环的免疫系统“士兵”负责识别和对抗感染和癌细胞。一种名为 TSC2(tuberous sclerosis protein 2)的蛋白能够激活或阻断调节这些 T 细胞的分子通路。
总体来说,他们的实验表明,在TSC2基因中引入突变就像一个分子“音量旋钮”,当这些T细胞积极应对病毒或癌症抗原等免疫挑战时,它可以调高或调低它们的调节途径。就像音量旋钮一样,在音乐响起之前,它不会有任何变化,而音乐响起时它的音量就会变大。
这些作者发现,当这些发生突变的 T 细胞只是处于静止状态,没有受到刺激去攻击目标时,它们的行为与正常的 T 细胞并无不同。只有在受到刺激时,它们才会变得更加活跃。对于 T 细胞来说,这种控制方式相对较新。
Kass说,这一发现提高了增强 CAR-T细胞疗法的可能性,在这种疗法中,T 细胞经过基因改造后能够更好地识别特定癌症。如果这些T细胞也发生TSC2基因突变,那么它们就能通过增殖对肿瘤发挥更大的活性,而且还能持续更长时间,从而增强它们杀死癌症的疗效。
8. Cell Rep:T细胞受体研究发现或有望帮助工程化量身定制特殊的免疫反应
doi:10.1016/j.celrep.2023.113279
T细胞是人类免疫系统前线的战士,其负责扮演着多种重要的角色,包括攻击病毒或细菌感染的细胞和特定的癌细胞,同时还会产生一定的免疫记忆,即能记住最初诱发T细胞的特定病原体或癌症特征。截止到目前为止,理解T细胞如何形成并发挥特定的作用,比如细胞毒性T细胞或记忆T细胞,一直困扰着研究人员,近日,一篇发表在国际杂志Cell Reports上题为“T cell receptor sequences are the dominant factor contributing to the phenotype of CD8+ T cells with specificities against immunogenic viral antigens”的研究报告中,来自Fred Hutchinson癌症研究中心等机构的科学家们通过研究发现,人类在儿童早期所发育的遗传编码T细胞受体(TCR)序列或许决定了T细胞的功能。

T细胞受体研究发现或有望帮助工程化量身定制特殊的免疫反应。图片来源:Cell Reports (2023). DOI:10.1016/j.celrep.2023.113279。
文章第一作者Daniel Chen说道,受体序列是主要的决定因素,而不是诸如细胞因子或其它血液组分等信号蛋白,正是受体序列(T细胞上能结合外来抗原的特殊蛋白)才决定了细胞的表型,从而就决定了其功能。在这项纳入了68名患者的人类临床试验研究中,研究人员深入分析了大约700个T细胞,这些T细胞能与来自SARS-CoV-2、流感病毒或巨细胞病毒上的抗原进行特异性的相互作用。这一基本发现的潜力就是开发针对特定抗原的定制化免疫反应。
研究者认为,T细胞受体工程化T细胞癌症免疫疗法是目前新兴的治疗实体瘤的疗法,在诸如此类疗法中,组成药物的T细胞通常会被设计成为能积极性地杀灭癌细胞,研究人员都知道,一种成功的免疫反应需要T细胞表型的平衡,其中一些能杀灭肿瘤细胞,但另一些则会形成记忆或者具备其它功能。如今研究人员表明,他们基本可以找到一张卡片目录,如果你想设计一种平衡的免疫反应,就需要在卡片目录上寻找并找到特定的TCR基因,当设计构建细胞疗法时,或许就能提供平衡的反应;不同的抗原需要不同的“卡片”目录,然而,很多抗原具有一定的免疫原性,这就意味着对于同一疾病的不同患者,其机体中的T细胞通常会靶向作用相同的抗原,这一点或许非常重要,因为这意味着我们从一个病人身上所学到的东西或许适用于另一个病人。(生物谷 Bioon.com)
相关生物谷新闻:
CAR-T细胞疗法研究进展(第38期)
https://news.bioon.com/article/9888e93783f1.html
CAR-T细胞疗法研究进展(第37期)
https://news.bioon.com/article/caf3e83979c2.html
CAR-T细胞疗法研究进展(第36期)
https://news.bioon.com/article/b9b6e6929370.html
CAR-T细胞疗法研究进展(第35期)
https://news.bioon.com/article/4b40e613612e.html
CAR-T细胞疗法研究进展(第34期)
https://news.bioon.com/article/4198e575451e.html
CAR-T细胞疗法研究进展(第33期)
https://news.bioon.com/article/c0b4e49733ba.html
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


